Isso está correto, existem vários metais indesejados (ou tramp) (Cu, Sn, Sb, As) que entram no fluxo de reciclagem de, por exemplo, carrocerias de carros que são trituradas em sucata sem remover toda a fiação de cobre ou estanho latas de aço revestidas. O antimônio e o arsênico tendem a surgir de fontes primárias de ferro de baixa qualidade e baixo custo.
A resposta para a pergunta é não. O aço reciclado é misturado da maneira mais uniforme possível a partir de fontes variadas, sua composição é medida e, em seguida, é adicionado ferro puro, conforme necessário, para diluir os metais pesados a níveis toleráveis para revenda ou processamento adicional, como atender a uma classe de aço específica para um produto específico ou aplicativo. Aços inoxidáveis e outras classes de alta liga, conhecidas no momento da reciclagem, são processadas separadamente devido ao valor de Ni, Cr, etc.
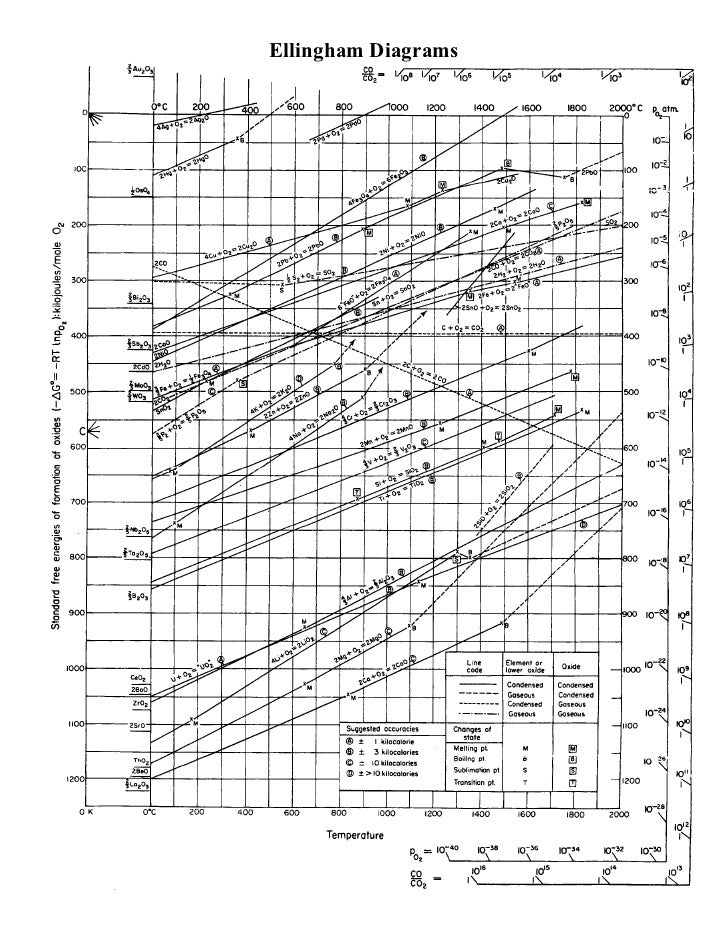
Atualmente, não é econômico reprocessar o ferro para remover os elementos de tramp e, portanto, isso simplesmente não é feito. Dois livros mencionam o processo como regular e econômico: ( Minerais, Metais e Sustentabilidade: Atendendo às Necessidades Futuras de Materiais , p. 284, iniciando em "diluição") e ( Produção de Aço: Processos, Produtos e Residuais, começando na p. 104, leia até que não seja mais relevante). A razão pela qual é antieconômico é que os elementos do tramp reagem mais fracamente com oxigênio que o ferro a temperatura constante; portanto, para removê-los por oxidação, é necessário oxidar todo o ferro primeiro. A razão para isso é termodinâmica e se baseia no fato de que, entre as reações concorrentes, as que apresentam as maiores reduções de energia livre prosseguem virtualmente até a conclusão antes de outras reações começarem, especialmente com grandes diferenças de energia livre entre as reações concorrentes. Para determinar quais reações têm as maiores diminuições, um diagrama de Ellingham pode ser usado.
No diagrama de Ellingham abaixo, o eixo horizontal é a temperatura, o eixo vertical é a mudança na energia livre de Gibbs. As linhas que percorrem o diagrama em vários ângulos correspondem à mudança de energia livre causada pelas reações de oxidação do elemento com o oxigênio, em função da temperatura. No nosso caso, o diagrama pode ser lido escolhendo uma temperatura de interesse e lendo de baixo para encontrar o primeiro elemento a reagir com o oxigênio. Por exemplo, se tivermos aço com Fe, Mn, Sn e Cu, podemos ver que a 1000K, então Mn, Fe (para FeO), Sn e Cu são a ordem da maior para a menor queda na energia livre.
Concedido, a temperatura de interesse é mais próxima de 1900K (acima do ponto de fusão do ferro), mas as tendências gerais de cada função de mudança de energia livre de Gibbs continuam à direita no diagrama e o ferro permanece abaixo dos elementos de trilho Cu, Sn, As e Sb a temperaturas práticas e provavelmente aos seus respectivos pontos de ebulição. Como resultado, remover os vagabundos do Fe exigiria oxidar efetivamente todo o ferro primeiro. E como Sn, Sb, As e Cu são levemente solúveis em ferro, requerem separação por reação química.
Pode-se ver a solubilidade dos vagabundos a partir de seus diagramas de fases com ferro, dos quais eu publiquei Sb-Fe abaixo. O diagrama tem temperatura versus composição, com cada região 2D contígua composta por uma fase ou uma mistura das duas fases à esquerda e à direita, que estão em equilíbrio nessa combinação de temperatura e composição. No canto inferior esquerdo, vemos que, para pequenas quantidades de Sb e temperatura ambiente, existe uma região contígua que, neste caso, denota uma fase única, ou alfa-Fe (o tipo com o qual estamos familiarizados). Como há Sb presente, e está em uma única fase, ele deve ser dissolvido no ferro. O mesmo é verdade, com severidade variável, dos outros vagabundos.

(fonte: himikatus.ru )
Como Chris H comentou, há uma questão também de quando outros elementos de liga são controlados. Geralmente a adição de liga é controlada o mais próximo possível da solidificação, para minimizar a perda de liga.
A sucata é derretida a granel em um forno elétrico a arco. Se o fluxo de sucata é suficientemente misturado, a concentração de tramp pode ser estimada com base no uso passado e o ferro primário é adicionado antes da análise química para compensar a estimativa. A massa é então derretida, o oxigênio é removido através da adição de elementos na parte inferior do diagrama de Ellingham, especificamente Ca e Al, e o metal fundido é transferido para uma ou mais conchas altamente isoladas. O Ca e o Al reagem rapidamente com o oxigênio dissolvido no fundido para criar escória de óxido de baixa densidade que flutua e é removida mecanicamente. A química é obtida após esse processo e, se os vagabundos são suficientemente diluídos, o metal é transferido para conchas. Caso contrário, ferro primário suficiente é adicionado para diluir a fusão.
Uma vez na concha, elementos adicionais de liga são adicionados. Eles não foram adicionados anteriormente devido ao diagrama de Ellingham: a maioria dos elementos de liga, incluindo Mn, Mo, Cr, V, C, etc., tem maior perda de energia livre que o Fe e, portanto, reage primeiro. Em outras palavras, eles desaparecem. Para evitar o desbotamento caro da adição de liga, eles são adicionados o mais próximo possível do processo de solidificação. Além disso, ao remover o oxigênio usando Al e Ca primeiro, há menos oxigênio dissolvido no ferro para reagir com os elementos de liga mais caros. Uma vez na concha, há muito pouca turbulência na interface líquido-atmosfera; portanto, a difusão de novo oxigênio no ferro líquido é relativamente lenta. Obviamente, ainda há um limite de tempo, e segurar uma concha por muito tempo causará o desbotamento da liga. Após a adição da liga, a química é verificada e a concha é derramada.
Editado para adicionar fontes. Editado para adicionar discussão sobre controle de liga.

